日前,健康元药业集团股份有限公司发布公告称,其控股子公司丽珠集团控股附属公司丽珠试剂自主研发的新型冠状病毒抗原检测试剂盒获国家药品监督管理局批准注册上市,该新冠抗原检测试剂盒适用于鼻咽拭子,口咽拭子,鼻拭子三种样本类型,检测时间仅需15分钟,操作简单,结果清晰,易于判读,无需实验室,可用于自测。
在当前Omicron传播迅速的情况下,按照流行病学防控要求,快速识别传染源,需要更加简便,易行并且容易推广的检测技术,以适应当下毒株的流行特征,从而应对更多的人群开展大规模快速检测目前市场上,已取得注册证的自测抗原试剂方法学分别有荧光免疫层析法,胶体金法和乳胶法其中,荧光免疫层析法是需要额外的设备配合判读的,自测的时候基本无法使用,而胶体金法和乳胶法是不需要仪器可以自己检测的
据介绍,丽珠试剂自研的新型冠状病毒抗原检测试剂盒在检测上比胶体金法更具优势:一方面,采用彩色乳胶微球粒作为信号标记,乳胶微球粒径均一,且比常规胶体金颗粒大5—10倍,则乳胶法在检测灵敏度上有所提高,另一方面,彩色乳胶微球合成时掺入了羧基等活化基团,标记抗体与乳胶通过化学键共价连接,所以比胶体金与蛋白之间通过电荷连接更稳定。
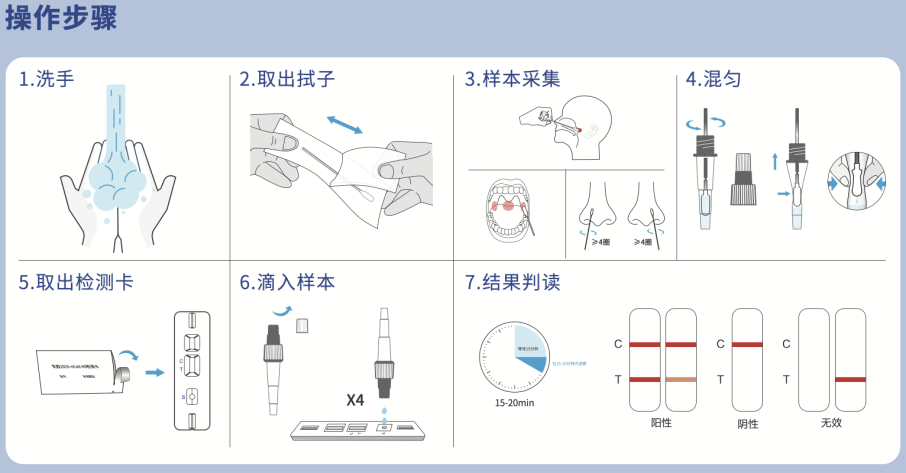
从具体优势来看,该产品简便易行,无需任何仪器设备就可进行快速自我检测,在15—20分钟内获取检测结果,该产品设计友好,提供了适用鼻咽拭子,口咽拭子,鼻拭子,以及1人份/盒,5人份/盒,20人份/盒的多样本类型,多规格及组分设计,可以满足不同场景需求。
 更重要的是,该产品在临床试验中采用了国内人群的数据验证,更贴合当前国内情况,使得结果更可靠。2021年5月17日,广东省医疗保障局,广东省卫生健康委员会,广东省药品监督管理局联合发布《关于做好我省新型冠状病毒检测试剂采购和使用工作的通知》,正式落地此次集采。
日前,国家卫生健康委员会发出《新冠病毒抗原检测应用方案》,首次提出在核酸检测基础上,增加抗原检测作为补充鉴于此,丽珠试剂根据政策加快相关工作,在珠海市委,市政府,香洲区委,区政府,药监等各级部门的指导下,以最快的速度完成注册资料的准备,并于3月29日向国家药品监督管理局提交了注册申请,4月12日取得注册证抗原检测试剂盒,注册证号:国械注准20223400470)在此之前,丽珠试剂新冠抗原试剂盒已获得欧盟CE,英国,印尼和泰国注册证,以及法国,德国,奥地利等国家和地区的白名单准入资格,产品销往欧盟,亚太等多个国家和地区
丽珠试剂新型冠状病毒抗原检测试剂盒用于体外定性检测新型冠状病毒N蛋白抗原,可以应用于医疗机构,也可在隔离人员,密接人员,有自我检测需求的社区居民中进行自我检测,有效缓解国内检测压力,对新冠病毒感染早期检测具有重要意义。。
。郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。
|
